Définitions
A - Verre
Les solides sont caractérisés à la fois par leur incapacité à prendre la forme du récipient dans lequel ils prennent place, et par leur grande résistance aux forces de cisaillement. On les classe en deux catégories : les solides cristallisés et les solides amorphes (qu’on appelle aussi parfois désordonnés ou non-cristallisés)
- Un solide cristallisé est constitué de cristaux dont l’arrangement des atomes, périodique dans l’espace, répond à des règles précises.
- Dans un solide amorphe au contraire, les atomes observés par diffraction des rayons X, sont aussi désordonnés que dans un liquide. L’ordre à longue distance que l’on trouve dans les cristaux n’existe plus. Il n’y a qu’un ordre à l’échelle de la distance interatomique.
Les solides amorphes sont caractérisés par une énergie interne en excès par rapport aux autres états de la matière, si bien que si on les chauffe, ils subissent naturellement une transformation qui apparaît avant que la température de fusion ne soit atteinte.
Pour certains solides amorphes cela caractérise un passage spontané plus ou moins violent vers l’état cristallisé.
Pour la catégorie importante de solides amorphes qu’on appelle verre, le phénomène de la transition vitreuse est toujours présent: passage de l’état solide à l’état liquide visqueux.
On peut donc définir le verre ainsi :
Le verre est un solide non cristallisé qui présente le phénomène de transition vitreuse.
 B - Transition vitreuse
B - Transition vitreuse
Ce phénomène est illustré par l’évolution du volume en fonction de la température. On peut décrire la courbe comme suit :
Nous disposons d’un liquide visqueux à la température TL et nous souhaitons lui faire franchir cette température sans qu’il y ait cristallisation. On observe que le volume du liquide visqueux en dessous de TL se situe d’abord dans l’extrapolation des valeurs qu’il prend au dessus de TL. Mais à la température TG où la viscosité atteint environ 1012 Pa.s il y a une diminution significative de la pente de la courbe de variation qui devient proche de celle que présente un solide cristallisé. En revanche à cette température TG on n’observe pas de changement brutal de volume comme c’est le cas lorsqu’il y a passage de l’état liquide à l’état solide. Ceci montre qu’il n’y a pas de variation structurale au passage de TG. La substance obtenue au-dessous de Tg qui a la structure du liquide mais les propriétés du solide est le verre.
Ce phénomène de transition vitreuse peut aussi s’observer en suivant les variations en fonction de T de l’indice de réfraction, de l’enthalpie ou encore de la conductivité électrique. On constate systématiquement à TG un changement de la pente.
C - Réseau
Un réseau représente la périodicité de la distribution atomique dans une structure cristalline (réseau de Bravais). Dans notre cas il ne s’agit pas d’une structure cristalline, on parle plutôt de réseau vitreux pour ne pas confondre, mais on a bien un réseau car on a une structure en trois dimension.
Nous allons maintenant présenter les différents constituants d’un verre.
D - Formateur de réseau
Les formateurs de réseau sont des éléments qui peuvent à eux seuls former un verre.
On peut citer comme exemples: B2O3, SiO2, GeO2, P2O, As2O5, V2O5.
Lorsqu’ils sont à l’état liquide, ils donnent isolément des verres en se refroidissant à vitesse modérée.
Prenons un exemple : SiO2 appelé aussi cristobalite est un formateur de réseau qui pose cependant un problème : sa température de fusion est très élevée 1723°C. A cette température le liquide est très visqueux ce qui rend difficile les opérations suivantes :
- Elaboration
- Mise en forme
Depuis fort longtemps on sait qu’il est possible d’abaisser cette température et de fluidiser le liquide en ajoutant au sable des produits appelés fondants, ou modificateurs de réseau.
E - Modificateur de réseau
Les modificateurs de réseau ne peuvent pas former de verre à eux seuls.
 On doit la découverte des modificateurs de réseau au hasard: il y a eu chauffage fortuit d’un mélange de sable et d’un sel alcalin naturelle « nitre » :
On doit la découverte des modificateurs de réseau au hasard: il y a eu chauffage fortuit d’un mélange de sable et d’un sel alcalin naturelle « nitre » :
SiO2+Na2CO3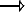 Na2SiO3+CO2 (g)
Na2SiO3+CO2 (g)
L’introduction de NaO dans le réseau à deux effets:
- La molécule coupe une chaîne O-Si-O-Si-O et forme donc O-Si-O-
- On a transformation des oxygènes pontants (liés à deux cations formateurs) en oxygènes non-pontants (lié à un seul cation formateur).
L’introduction des oxydes alcalins crée des discontinuités dans le réseau de silice ce qui entraîne :
- Une réduction de la viscosité
- Une élaboration facilitée
On peut comparer avec l’effet des alcalino-terreux, comme par exemple CaO sur la température du liquidus.
Si l’on compare ces deux diagrammes de phase, on observe que l’eutectique n’est pas à la même température. En effet il est à 1436°C pour CaO-SiO2 et à 796°C pour Na2O-2SiO2. Il est donc plus facile d’élaborer du verre avec du Na2O qu’avec du CaO.
Les alcalino-terreux n’abaissent pas autant la température du liquidus, la formation du verre est moins favorable.
F - Oxyde intermédiaire
On peut caractériser l’aptitude des cations à former un réseau avec l’ion oxygène par la force d’attraction coulombienne qui les lie lorsque leur distance est égale à la somme des rayons ioniques. On appelle intensité de champ la quantité A :
- Zc est la valence du cation
- Rc rayon du cation (Å)
- Ro rayon de O2- (Å)
Les cations oxydes formateurs correspondent à A>1.0
Les oxydes modificateurs pour lesquels A<0.35
Entre ces deux catégories d’oxyde, il en existe une autre moins nettement définie et qui peut jouer selon la composition du verre le rôle de formateur ou de modificateur. Il s’agit des oxydes intermédiaires.
Figure 1 : From Le verre science et technologie-James Barton
Figure 2 : From Le verre science et technologie-James Barton et Claude Guillemet
Figure 3 : From Le verre science et technologie-James Barton et Claude Guillemet
Figure 4 : From Le verre science et technologie-James Barton et Claude Guillemet






